الدور الحيوي
الحديد ضروريٌّ وأساسيٌّ لوجود الحياة. إذ تنتشر العناقيد الكبريتية الحديديّة في عددٍ من الإنزيمات، من ضمنها النتروجيناز، وهو إنزيم مسؤولٌ عن عمليّات تثبيت النيتروجين الحيوية.
كما تساهم البروتينات الحاوية على الحديد في عمليّات نقل وتخزين واستخدام الأكسجين؛ وكذلك في عمليّات انتقال الإلكترون البَينيّة.
يمكن للنمو الميكروبي أن يُعزّز عبر أكسدة الحديد الثنائي أو اختزال الحديد الثلاثي.
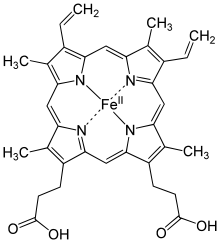
تعدّ بروتينات الهيم أشهر الأمثلة على البروتينات الحاوية على الحديد في جسم الإنسان، كل من الهيموغلوبين (خضاب الدم) والمَيوغلوبين وسيتوكروم P450 .
تساهم هذه البروتينات في نقل الغازات وبناء الإنزيمات ونقل الإلكترونات.
من الأمثلة على البروتينات الفلزّية الحاوية على الحديد كلّ من الفيرّيتين والروبردوكسين ؛
كما يوجد هناك عددٌ من الإنزيمات المهمّة الحاوية على الحديد مثل الكاتالاز ، وليبوكسيجيناز ،
بالإضافة إلى الإنزيم الرابط لعنصر الاستجابة للحديد؛ والفرّيدوكسين .
على العموم يشكّل اكتساب الحديد تحدّياً بالنسبة للكائنات الهوائية، إذ أنّ الحديديك (أيون الحديد الثلاثي) ضعيف الانحلالية في الأوساط المعتدلة؛ بالتالي ينبغي لتلك الكائنات أن يكون الحديد فيها على شكل معقّد، وأحياناً يؤخذ الحديد على هيئة حديدوز قبل أن يؤكسَد إلى حديديك. وخاصّةً عند البكتريا، الحاوية على عوامل حاجزة تدعى حاملات الحديد .
عند الإنسان
يحوي جسم إنسان بالغ وسطياً على 0.005% (خمسة بالألف) من وزنه حديداً، وذلك يعادل حوالي أربعة غرامات؛ ويكون حوالي ثلاث أرباع تلك الكمّيّة على هيئة هيموغلوبين، وهي سويّة تبقى ثابتة على الرغم أنّ حوالي ميليغرام واحد من الحديد يُمتصّ يومياً من الجسم؛ لأنّ الجسم يعيد تدوير الهيموغلوبين من أجل الحفاظ على محتوى الحديد فيه.
بعد دخوله إلى الوسط الخلوي داخل جسم الإنسان، يُضبَط مستوى الحديد بشكلٍ دقيق؛ ويساهم بروتين الترانسفرّين بدورٍ أساسيِّ في ذلك، إذ يقوم بالارتباط مع أيونات الحديد الممتصّ في منطقة الاثنا عشري، وينقله في مجرى الدم إلى الخلايا.
يحوي بروتين ترانسفرّين على أيون الحديديك 3+Fe في مركز ثماني سطوح مشوّه الشكل ، والذي يرتيط مع ذرّة نتروجين وثلاث ذرّات أكسجين، بالإضافة إلى وجود أنيون كربونات مُمَخْلِب قادرٍ على احتجاز أيونات الحديديك في الداخل.
يُختزَل الحديد في الترانسفرّين في نخاع العظام من الحديديك إلى الحديدوز ليتحوّل الترانسفيرّين بذلك إلى فِرّيتين .
يساهم الهيموغلوبين (خضاب الدم) في نقل الأكسجين في كريات الدم الحمراء ويمنحها اللون الأحمر، ويقوم بنقل الأكسجين في الشرايين من الرئتين إلى العضلات، حيث يُحوّل هناك إلى ميوغلوبين، والذي يُخزّن إلى حين الحاجة إليه من أجل الأكسدة الاستقلابية للغلوكوز المولّدة للطاقة. يرتبط الهيموغلوبين مع ثنائي أكسيد الكربون الناتج عن أكسدة الغلوكوز وينقله عبر الأوردة على هيئة أنيون بيكربونات عائداً إلى الرئتين، حيث يُطرَح مع الزفير.
يقع الحديد في الهيموغلوبين في واحد من أربع مراكز من الهيم، ويكون الحديد فيه سداسي التناسق، بحيث يكون الحديد قادراً على تشكيل ستّ روابط تناسقية: أربع روابط مع ذرّات نتروجين في حلقة البورفيرين، ورابطة خامسة مع ذرّة نتروجين في حلقة إيميدازول في الحمض الأميني الهستيدين الطرفي والمتوفّر من سلسلة جانبية من البروتين المرتبط بالهيم، ورابطة سادسة محجوزة ومخصّصة من أجل الارتباط مع جزيء الأكسجين.
عندما لا يرتبط الهيموغلوبين مع الأكسجين، والذي يدعى حينها هيموغلوبين منزوع الأكسجين (ديوكسي هيموغلوبين) تكون أيونات الحديدوز 2+Fe في مركز الهيم في حالة تشكيل إلكتروني مرتفع اللفّ المغزلي ، ممّا يزيد من حجمها، بالتالي تصبح الفجوة في منتصف حلقة البورفيرين صغيرةً عليها، ممّا يؤدّي إلى نتوء أيونات الحديدوز بمسافةٍ مقدارها 55 بيكومتر، وبالتالي إلى تغيّر الشكل الهندسي للجزيء، ممّا يؤدّي إلى حجب الموقع السادس المخصّص للأكسجين عبر الارتباط مع نتروجين من هيستيدين طرفي آخر.
عندما يلتقط الهيموغلوبين منزوع الأكسجين جزيء أكسجين، فإنّ الهيستيدين الطرفي يتنحّى جانباً ويعود إلى موضعه عند الارتباط الوثيق لجزيء الأكسجين، والذي يشكّل رابطة هيدروجينية معه.
ممّا يجعل أيون الحديدوز 2+Fe في حالة تشكيل إلكتروني منخفض اللفّ المغزلي ، وذلك يخفّض من الحجم الذي تشغله فراغياً بمقدار 20%، ممّا يمكّن من عودتها إلى الفجوة في منتصف حلقة البورفيرين، بالتالي يعود الشكل الهندسي للجزيء مستوياً مرّة أخرى. بالإضافة إلى ذلك، فإنّ الرابطة الهيدروجينية المذكورة تساهم في إمالة جزيء الأكسجين، بحيث تصبح زاوية الرابطة Fe–O–O حوالي 120°، وذلك يجنّب تشكيل روابط جسرية مثل Fe–O–Fe أو Fe–O2–Fe، والذي قد يؤدّي وجودها إلى حدوث انتقال إلكتروني، أو إلى أكسدة الحديدوز إلى حديديك، أو إلى تَهَدّم سلسلة بروتين الهيموغلوبين، الأمر الذي يؤدّي إلى تغيّر شكل وحدات أخرى في الهيموغلوبين لتتشكّل بذلك ألفة كيميائية تجاه الأكسجين، بالتالي عندما يقوم الهيموغلوبين منزوع الأكسجين بالتقاط الأكسجين فإنّ ألفته تجاه الأكسجين ستزداد، والعكس صحيح. من جهةٍ أخرى، فإنّ جزيء الميوغلوبين يحوي على مجموعة هيم واحدة، بالتالي لا تحدث ظاهرة تأثّر الألفة بمجموعات الهيم الأخرى.
لذلك فإنّ الهيموغلوبين يكون شبه مشبعاً بالأكسجين في المناطق مرتفعة الضغط الجزئي من الأكسجين والموجودة في الرئتين، ولكن بالمقابل تكون ألفته تجاه الأكسجين أقلّ بكثير من تلك التي للميوغلوبين، والذي يتأكسج حتّى في ضغوط جزئية منخفضة من الأكسجين والموجودة في أنسجة العضلات.
يؤدّي وجود ثنائي أكسيد الكربون في المحيط إلى التقليل من ألفة الهيموغلوبين إلى الأكسجين، كما هو معروف في تأثير بور.
هناك بعض الجزيئات ذات التأثير السمّي على الإنسان، مثل أحادي أكسيد الكربون CO وثلاثي فلوريد الفوسفور PF3، والتي تعود سمّيتها إلى ارتباطها إلى الهيموغلوبين بشكل أوثق من ارتباط الأكسيجن، ممّا يؤدّي إلى تثبيط عمليات نقل الأكسجين إلى خلايا الجسم.
يدعى جزيء الهيموغلوبين عند ارتباطه مع أحادي أكسيد الكربون باسم كربوكسي هيموغلوبين.
تحوي بروتينات السيتوكروم على مجموعات هيم، وهي تدخل في عمليات الأكسدة الاستقلابية للغلوكوز بالأكسجين؛ ويرتبط حينها الموقع السادس إمّا بنتروجين إيميداوزل أو بذرّة كبريت من ميثيونين، ممّا يجعل من تلك البروتينات خاملةً بشكل كبير تجاه الأكسجين.
يبقى الحديد عند الانتقال الإلكتروني في حالة لفٍّ مغزليٍّ منخفض، إلّا أنّ حالة الأكسدة للحديد تتغيّر بين +2 و+3.
تعدّ البروتينات الحديدية الكبريتية ذات أهمية كبيرة، فهي تساهم في عمليات الانتقال الإلكتروني البَينيّة. تحوي هذه البروتينات على تجمّعات عنقودية من ذرّات الحديد والكبريت، وذلك في بنىً معقّدة؛ وقد يصل عدد ذرّات الحديد فيها إلى ثمان ذرّات. أمّا أبسط تلك البروتينات فهو الروبردوكسين، والحاوي على ذرّة حديد واحدة متناسقة إلى أربع ذرّات من الكبريت.
التغذية والصحة
 الحديد واسع الانتشار في الغذاء؛ ومن المصادر الغذائية المعروفة بارتفاع محتواها من الحديد كلّ من اللحوم الحمراء ولحوم الدواجن والسمك والمحار والبقوليات والورقيات، وكذلك في التوفو ودبس السكر. في بعض البلدان يُدعّم الخبز وحبوب الفطور بالحديد كما هو الحال في بريطانيا. يمكن أن يُستحصَل على الحديد ضمن المكمّلات الغذائية على هيئة فومارات أو كبريتات الحديد الثنائي. يتوافر الحديد حيوياً بشكل أكبر غالباً عندما يكون مُتَمَخْلِباً مع الأحماض الأمينية؛ مثل الغلايسين.
الحديد واسع الانتشار في الغذاء؛ ومن المصادر الغذائية المعروفة بارتفاع محتواها من الحديد كلّ من اللحوم الحمراء ولحوم الدواجن والسمك والمحار والبقوليات والورقيات، وكذلك في التوفو ودبس السكر. في بعض البلدان يُدعّم الخبز وحبوب الفطور بالحديد كما هو الحال في بريطانيا. يمكن أن يُستحصَل على الحديد ضمن المكمّلات الغذائية على هيئة فومارات أو كبريتات الحديد الثنائي. يتوافر الحديد حيوياً بشكل أكبر غالباً عندما يكون مُتَمَخْلِباً مع الأحماض الأمينية؛ مثل الغلايسين.
التوصيات الغذائية
قَدّرَت الأكاديمية الوطنية للطب في الولايات المتّحدة الأمريكية (سابقاً تحت اسم المعهد الأمريكي للطبّ) معدّل الحاجة التقريبي من الحديد في سنة 2001؛
- للنسوة بمقدار 7.9 مغ/اليوم بالنسبة للاتي أعمارهن بين 14-18 سنة؛
- وبمقدار 8.1 مغ/اليوم للاتي أعمارهن بين 19-50؛
- وبمقدار 5.0 مغ/اليوم للأسن من ذلك؛
أمّا الكمية المُوصى بتناولها للحوامل فهي
- مقدار 27 مغ/اليوم،
- وللمرضعات بمقدار 9 مغ/اليوم؛
- وهي بالنسبة للأطفال الذين أعمارهم بين 1-3 سنة بمقدار 7 مغ/اليوم،
- وبين 4-8 سنة بمقدار 10 مغ/اليوم،
- وبين 9-13 سنة بمقدار 8 مغ/اليوم؛
- أمّا بالنسبة للرجال فحُدِّد معدّل الحاجة التقريبي بمقدار 6.0 مغ/اليوم لمن تتجاوز أعمارهم 19 سنة، والكمّية الموصى بتناولها بمقدار 8.0 مغ/اليوم؛
- مع العلم أنّ المستوى الأقصى المقبول بالنسبة للحديد هو مقدار 45 مغ/اليوم.
وضعت الهيئة الأوروبية لسلامة الأغذية مقادير ضابطة مقاربة لما هو متّبع في الولايات المتّحدة.قد يحتاج الأطفال الرضّع إلى مكمّلات الحديد، إن كان الإرضاع مصدره حليب البقر. من جهةٍ أخرى، قد يحتاج المتبرّعون بالدم دورياً إلى تناول مكمّلات الحديد أيضاً. تبلغ نسبة القيمة اليومية الكافية للحصول على المدخول الكافي من الحديد، والموضوعة على ملصقات المكمّلات الغذائية في الولايات المتّحدة مقدار 18 مغ.
عوز الحديد
يعدّ عوز الحديد (أو نقص الحديد) أحد أكثر أشكال سوء التغذية شيوعاً في العالم.
يحدث هذا النقص عندما لا تُعوّض كمّيّة الحديد في الجسم عبر مصدر غذائي ملائم، ممّا يؤدّي مع مرور الوقت إلى حدوث عوز كامن في البداية، والذي قد يتطوّر في حال عدم المعالجة إلى فقر الدم الناجم عن عوز الحديد ، والذي يُشخّص بعدم وجود عددٍ كافٍ من خلايا الدم الحمراء، وبكمّية غير كافية من الهيموغلوبين (خضاب الدم).
باتّباع حميةٍ مناسبةٍ يمكن الشفاء من هذا المرض؛ وتكون أعراض هذا العوز في العادة متوسّطة الشدة، وفي حال عدم المعالجة يمكن أن يتسبّب ذلك بظهور مشاكل مثل
- اضطراب النظم القلبي،
- وبمضاعفات أثناء الحمل،
- وبتأخر النموّ عند الأطفال.
فرط الحديد
يُضبَط مستوى الحديد في الإنسان صحيح الجسم بشكلٍ دقيقٍ عند استقلابه، بحيث أنّ القسم الأكبر يعاد تدويره، ولا يُطرَح منه خارج الجسم إلا كمّيّات صغيرةٍ يومياً بسبب انسلاخ الخلايا الطلائية الظهارية والمخاطية الداخلية؛ بالتالي فإنّ ضبط مستوى الحديد في الجسم يحدث بضبط المأخوذ اليومي منه. يحدث لدى البعض خللٌ في ضبط مستوى الحديد نتيجة اضطراب جيني في الصبغي السادس، والذي يؤدّي إلى انخفاضٍ غير طبيعيٍّ في مستوى بروتين الهيبسيدين ، وهو عاملٌ أساسيٌّ مهمٌّ في ضبط دخول الحديد إلى جهاز الدوران عند الثدييات.
بالتالي فإّن تناول كمّيّات فائضة من الحديد يؤدّي إلى حدوث حالة فرط الحديد ، والتي تدعى طبياً داء الاصطباغ الدموي الوراثي ؛ وهو داءٌ غير واسع الانتشار، ويصيب أقلَّ من 1% من السكان؛ ولكن بالرغم من ذلك ينبغي استشارة الطبيب بخصوص تناول مكمّلات الحديد.
التسمم بالحديد
يؤدّي أخذ جرعاتٍ فائضةٍ من الحديد إلى التسبّب بارتفاع مستويات الحديد الحرّ في الدمّ، وذلك يؤدّي إلى تفاعل الحديدوز مع البيروكسيدات، ممّا ينتج جذوراً كيميائيةً حرّةً، والتي يمكن أن تسبّب الضررَ داخل الجسم، ويحصل حينها ما يعرف باسم التسمّم بالحديد .
يحدث هذا العارض عندما تفوق مستويات الحديد الكمّيّات المتوفّرة من الترانسفرّين المسؤول عن الارتباط بالحديد ونقله داخل الجسم؛ ممّا يسبّب الأذى لخلايا الأجهزة والأعضاء الداخلية في الكبد والقلب، وذلك عن طريق ظهور أعراض تتضمّن
- فشل الكبد
- والسُحَار الحديدي ؛
- وكذلك الحماض الاستقلابي
- والصدمة
- والاعتلال الخثري
- ومتلازمة الضائقة التنفسية الحادة ،
- بالإضافة إلى الغيبوبة واحتمالية حدوث الوفاة.
تحدث حالة التسمّم بالحديد عندما تتجاوز كمّيّة الحديد 20 ميليغرام لكل كيلوغرام من وزن الجسم؛ وتعدّ كمّيةٌ مقدارُها 60 ميليغرام لكل كيلوغرام من وزن الجسم جرعةً مُميتةً.
تزداد احتمالية الإصابة بالتسمّم خاصّةً لدى الأطفال تحت سنِّ السادسة من العمر؛ لذلك ينبغي أن لا يتجاوز المستوى الأقصى المقبول من مأخوذ الحديد مقدار 40 ميليغرام/اليوم.
عند حدوث حالة التسمّم بالحديد يوصى بتناول عامل مُمَخْلب مثل ديفيروكسامين ، والذي يعمل على حجز الحديد الفائض في الجسم.